ПЦР тест, навязанный миру ВОЗ, не способен обнаруживать инфекцию!
 22 учёных со всего мира доказали это!
22 учёных со всего мира доказали это!
Внешняя экспертная оценка теста RT PCR для обнаружения SARS-CoV-2 выявляет 10 основных научных недостатков на молекулярном и методологическом уровне: последствия ложноположительных результатов.
У древних египтян не было бога-прокровителя мозга…
«Парасхиты Древнего Египта (жрецы-бальзамировщики), которые готовили тела умерших к вечной жизни, относились с самым серьёзным почтением ко всем внутренним органам человека. Печень, сердце, почки, желудок, кишечник, селезёнка, лёгкие et cetera по извлечению из трупа обмывались, бальзамировались и либо расфасовывались по сосудам, либо помещались обратно в мумию. Забвение или случайное уничтожение любого из внутренних органов исключалось, так как лишало покойника части статуса в загробном мире.
У каждого из органов была особая мистическая роль и свой бог-покровитель. Сердце, exempli causa, находилось под защитой бога Туамутефа (Книга Мёртвых, 2002. Гл. XXVI), желудок охранял бог Хапи, а печень - бог Кебсеннуф.
Помимо бога-покровителя каждый орган имел и врага-демона, старавшегося его повредить, украсть или уничтожить. Все органы при мумификации защищались от демонов-похитителей специальными амулетами из лазурита или сердолика.
Единственный орган, который без сожалений и раздумий выбрасывался парасхитами, был головной мозг. Его извлекали, как пишет Геродот, «через ноздри», а в реальности, вероятно, проламывая concha nasalis superior, os lacrimale, proc. uncinatus, т.е. верхнюю носовую раковину, слёзную кость и крючковидный отросток (Михайловский В. Г. Опыт рентгенологического исследования египетских мумий, СМАЭ, 1928. Том 8).
Мозг не имел ни бога-покровителя, ни тайного имени. Он вообще не имел никакого значения и, после удаления из головы, мог быть даже «скормлен собакам». Вразумительных объяснений этому факту нет. Говорить о точном времени зарождения этой тенденции невозможно, но если мы датируем её эпохами III-V династий, а это 2600-2500 годы до н.э., то мы, вероятно, будем где-то недалеки от истины».
АННОТАЦИЯ
В публикации под названием «Обнаружение нового коронавируса 2019 года (2019-nCoV) с помощью ОТ-ПЦР в реальном времени» (Eurosurveillance 25 (8) 2020) авторы представляют рабочий процесс диагностики и протокол ОТ-КПЦР для обнаружения и диагностики 2019-nCoV. (теперь известный как SARS-CoV-2), который, по их утверждениям, прошел валидацию, а также является надежной диагностической методологией для использования в лабораторных условиях общественного здравоохранения.
В свете всех последствий, вытекающих из этой публикации для обществ во всем мире, группа независимых исследователей выполнила поэтапный обзор вышеупомянутой публикации, в котором:
1) все компоненты представленного дизайна теста были перепроверены,
2) Рекомендации протокола RT-qPCR были оценены с учетом надлежащей лабораторной практики, а
3) параметры были изучены по соответствующей научной литературе, охватывающей эту область.
Опубликованный протокол RT-qPCR для обнаружения и диагностики 2019-nCoV и рукопись страдают многочисленными техническими и научными ошибками, включая недостаточный дизайн праймеров, проблемный и недостаточный протокол RT-qPCR и отсутствие точной проверки теста. Ни представленный тест, ни сама рукопись не отвечают требованиям для приемлемой научной публикации. Далее не упоминаются серьезные конфликты интересов авторов. Наконец, очень короткий промежуток времени между подачей и принятием публикации (24 часа) означает, что систематический процесс рецензирования здесь либо не проводился, либо имел проблематичное низкое качество. Мы предоставляем неопровержимые доказательства ряда научных несоответствий, ошибок и недостатков. Учитывая представленные здесь научные и методологические недостатки, мы уверены, что у редакции Eurosurveillance нет другого выбора, кроме как отозвать публикацию.
КРАТКО О ДАННОМ ОБЗОРЕ
В этой статье будут показаны многочисленные серьезные недостатки в статье Кормана-Дростена, значимость которых привела к ошибочной диагностике инфекций, приписываемых SARS-CoV-2 и связанных с заболеванием COVID-19, во всем мире. Мы сталкиваемся с жесткими ограничениями, которые разрушили жизни и средства к существованию многих людей, ограниченным доступом к образованию, и эти ограничения, введенные правительствами по всему миру, являются прямым нападением на основные права людей и их личные свободы, что приводит к сопутствующему ущербу для экономики целых стран в мировом масштабе.
В статье Кормана-Дростена есть десять фатальных проблем, которые мы опишем и объясним более подробно в следующих разделах.
Первая и основная проблема заключается в том, что новый коронавирус SARS-CoV-2 (в публикации под названием 2019-nCoV и в феврале 2020 года названный международным консорциумом вирусных экспертов SARS-CoV-2) основан на in silico (теоретических) последовательностях, предоставленный лабораторией в Китае [1], поскольку в то время авторам не было доступно ни контрольный материал инфекционного («живого») или инактивированного SARS-CoV-2, ни выделенной геномной РНК вируса. На сегодняшний день авторство не провело валидацию на основе изолированных вирусов SARS-CoV-2 или их полноразмерной РНК. Согласно Корману и др .:
«Мы стремились разработать и внедрить надежную диагностическую методологию для использования в лабораторных условиях общественного здравоохранения без наличия вирусного материала». [1]
Здесь следует сосредоточить внимание на двух заявленных целях: а) разработке и б) развертывании диагностического теста для использования в лабораторных условиях общественного здравоохранения.
Эти цели недостижимы без наличия фактического вирусного материала (например, для определения инфекционной вирусной нагрузки). В любом случае только протокол с максимальной точностью может быть обязательной и основной целью в любом сценарии-исходе такого масштаба. Определение критической вирусной нагрузки является обязательной информацией, и Кристиан Дростен несет ответственность за выполнение этих экспериментов и предоставление важных данных.
Тем не менее, эти последовательности in silico были использованы для разработки методики тестирования ОТ-ПЦР для идентификации вышеупомянутого вируса. Эта модель была основана на предположении, что новый вирус очень похож на SARS-CoV 2003 года, поскольку оба являются бета-коронавирусами. Поэтому тест ПЦР был разработан с использованием геномной последовательности SARS-CoV в качестве контрольного материала для компонента Sarbeco; мы знаем это из нашего личного электронного сообщения [2], одного из соавторов статьи Кормана-Дростена. Этот метод моделирования SARS-CoV-2 был описан в статье Кормана-Дростена следующим образом:
«Создание и проверка диагностического рабочего процесса для скрининга на 2019-nCoV и специального подтверждения, разработанного в отсутствие доступных вирусных изолятов или оригинальных образцов пациентов. Дизайн и валидация стали возможными благодаря тесному генетическому родству с SARS-CoV 2003 года и использованию технологии синтетических нуклеиновых кислот».
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) - важная биомолекулярная технология для быстрого обнаружения редких фрагментов РНК, о которых известно заранее. На первом этапе молекулы РНК, присутствующие в образце, подвергаются обратной транскрипции с образованием кДНК. Затем кДНК амплифицируют в ходе полимеразной цепной реакции с использованием конкретной пары праймеров и термостабильного фермента ДНК-полимеразы. Технология очень чувствительна, и ее предел обнаружения теоретически составляет 1 молекулу кДНК. На специфичность ПЦР сильно влияют ошибки биомолекулярного дизайна.
Что важно при разработке теста RT-PCR и количественного теста RT-qPCR, описанных в публикации Кормана-Дростена?
1. Праймеры и зонды:
a) концентрация праймеров и зондов должна быть оптимального диапазона (100-200 нМ) b) должна быть специфичной для целевого гена, который вы хотите амплифицировать c) должна иметь оптимальный процент содержания GC относительно общего количества азотистых оснований ( минимум 40%, максимум 60%) г) для диагностики вирусов минимум 3 пары праймеров должны обнаруживать 3 вирусных гена (желательно как можно дальше друг от друга в вирусном геноме)
2. Температура, при которой происходят все реакции:
a) температура плавления ДНК (> 92 °) b) температура амплификации ДНК (специфическая для TaqPol) c) Tm; температура отжига (температура, при которой праймеры и зонды достигают целевого связывания / отсоединения, не должна превышать 2 ° C на пару праймеров). Tm сильно зависит от содержания GC в праймерах.
3. Количество циклов амплификации (менее 35, предпочтительно 25-30 циклов);
В случае обнаружения вируса более 35 циклов обнаруживают только сигналы, которые не коррелируют с инфекционным вирусом, как определено путем выделения в культуре клеток [обзор в 2]; если кто-то получил положительный результат с помощью ПЦР при использовании порога 35 циклов или выше (как в большинстве лабораторий в Европе и США), вероятность того, что этот человек действительно инфицирован, составляет менее 3%, вероятность того, что указанный результат является ложноположительным - 97% [обзор в 3]
4. Молекулярно-биологические подтверждения; амплифицированные продукты ПЦР должны быть проверены либо путем прогона продуктов в геле с линейкой ДНК, либо путем прямого секвенирования ДНК.
5. Следует указать положительный и отрицательный контроли для подтверждения / опровержения обнаружения конкретного вируса.
6. Должна быть доступна Стандартная операционная процедура (СОП).
В СОП однозначно указаны вышеуказанные параметры, поэтому все лаборатории могут установить одинаковые условия испытаний. Наличие утвержденной универсальной СОП очень важно, поскольку она позволяет сравнивать данные внутри стран и между странами.
Незначительные проблемы с публикацией CORMAN-DROSTEN
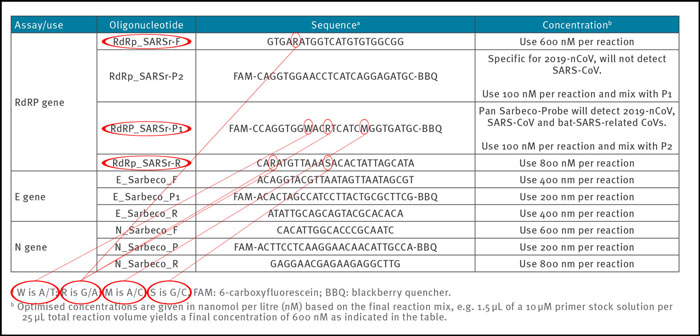
1. В таблице 1 статьи Кормана-Дростена указаны различные сокращения - указано «нМ», «нм» - нет. Далее, что касается правильной номенклатуры, нм означает «нанометр», поэтому здесь нм следует читать нМ.
2. По общему мнению, генетические последовательности всегда должны записываться в направлении 5'-3 ', включая обратные праймеры. Очень необычно выполнять выравнивание с обратной комплементарной записью последовательности праймера, как это сделали авторы на рисунке 2 статьи Кормана-Дростена. Здесь, кроме того, база колебания помечена как «y» без описания оснований, которые обозначает Y.
3. Две вводящие в заблуждение ошибки в работе Кормана-Дростена заключаются в том, что их таблица 1 не включает Tm-значения (значения температуры отжига), а также не показывает GC-значения (количество G и C в последовательностях как% -значение от всего баз).
ОСНОВНЫЕ ПРОБЛЕМЫ С РУКОПИСЬЮ КОРМАН-ДРОСТЕН
Подоплёка
Авторы представляют предысторию своей научной работы следующим образом: «Продолжающаяся вспышка недавно возникшего нового коронавируса (2019-nCoV) представляет собой проблему для лабораторий общественного здравоохранения, поскольку изоляты вируса недоступны, в то время как появляется все больше свидетельств того, что вспышка более распространена, чем изначально думали.
Б) МЕТОДЫ И РЕЗУЛЬТАТЫ
1. Праймер и конструкция зонда
1a) Ошибочные концентрации праймера
Надежные и точные протоколы тестирования ПЦР обычно разрабатываются с использованием 100 до 200 нМ на праймер [7]. В статье Кормана-Дростен мы наблюдаем необычно высокие и разные концентрации праймеров для нескольких праймеров (таблица 1). Для пар праймеров RdRp_SARSr-F и RdRp_SARSr-R описаны 600 нМ и 800 нМ соответственно. Точно так же для набора праймеров N_Sarbeco_F и N_Sarbeco_R они рекомендуют 600 нМ и 800 нМ соответственно [1]. Должно быть ясно, что эти концентрации слишком высоки, чтобы быть оптимальными для конкретных амплификаций генов-мишеней. В этом протоколе нет конкретной причины использовать эти чрезвычайно высокие концентрации праймеров. Скорее, эти концентрации приводят к усилению неспецифического связывания и амплификации продукта ПЦР.

1b) Неуказанные («шаткие») последовательности праймеров и зондов.
Для получения воспроизводимых и сопоставимых результатов важно четко определить пары праймеров. В статье Кормана-Дростена мы наблюдали шесть неуказанных положений, обозначенных буквами R, W, M и S (Таблица 2). Буква W означает, что в этой позиции может быть либо A, либо T; R означает, что может быть либо G, либо A; M указывает, что позиция может быть A или C; буква S указывает на то, что на этой позиции может быть буква G или C. Такое большое количество вариантов не только необычно, но и сбивает с толку лаборатории. Эти шесть неуказанных положений могут легко привести к созданию нескольких различных альтернативных последовательностей праймеров, которые не относятся к SARS-CoV-2 (2 различных праймера RdRp_SARSr_F + 8 различных зондов RdRp_SARS_P1 + 4 различных RdRp_SARSr_R). Изменения конструкции неизбежно приведут к результатам, даже не связанным с SARS CoV-2. Следовательно, сбивающее с толку неспецифическое описание в статье Кормана-Дростена не подходит в качестве стандартного рабочего протокола. Эти неуказанные позиции должны были быть разработаны недвусмысленно.
Эти шаткие последовательности уже вызвали беспокойство в этой области и привели к письму в редакцию, написанному Pillonel et al. [8] относительно явных ошибок в описанных последовательностях. Эти ошибки очевидны в Corman et al. добавка
В документе Кормана-Дростена также указывается третий ген, который, согласно протоколу ВОЗ, не прошел дальнейшей валидации и не был признан ненужным:
«Следует отметить, что анализ N-гена также показал хорошие результаты, но не подвергался дальнейшей интенсивной проверке, поскольку был немного менее чувствителен».
Это было досадным упущением, так как лучше всего было бы использовать ПЦР всех трех генов в качестве подтверждающих анализов, и это привело бы к почти достаточному протоколу диагностического инструмента обнаружения вирусной РНК. Три подтверждающих этапа анализа по крайней мере минимизируют ошибки и неопределенности на каждом этапе складывания в отношении «шатких» пятен. (Тем не менее, протокол все равно не соответствовал бы любой «хорошей лабораторной практике», если учесть все другие ошибки проектирования).
В его нынешнем виде, к сожалению, анализ N-гена не предлагается ни в рекомендации ВОЗ (рис. 1) в качестве обязательного и важного третьего подтверждающего шага, ни в документе Кормана-Дростена как важный необязательный аргумент «для рутинного рабочего процесса». (Таблица 2).
Следовательно, почти во всех испытательных процедурах во всем мире использовалось только 2 совпадения праймеров вместо всех трех. Такой надзор делает весь протокол испытаний бесполезным с точки зрения предоставления точных результатов испытаний, имеющих реальное значение в продолжающейся пандемии.

1c) Ошибочное содержание GC (обсуждается в 2c вместе с температурой отжига (Tm))
1г) Обнаружение вирусных генов
ОТ-ПЦР не рекомендуется для первичной диагностики инфекции. Вот почему тест ОТ-ПЦР, используемый в повседневной клинической практике для обнаружения COVID-19, не рекомендуется для диагностики COVID-19 на нормативной основе.
«Клиницисты должны осознавать повышенную точность и скорость молекулярных диагностических методов для диагностики инфекций, но также понимать их ограничения. Лабораторные результаты всегда следует интерпретировать в контексте клинической картины пациента, и для получения надежных результатов необходимы соответствующее место, качество и время сбора образцов». [9]
Однако его можно использовать, чтобы помочь врачу в дифференциальной диагностике, когда он или она должен различать различные инфекции легких (грипп, Covid-19 и SARS имеют очень похожие симптомы). Для подтверждения диагноза конкретного вируса необходимо применить не менее 3 специфических пар праймеров для обнаружения 3 вирусспецифических генов. Предпочтительно, чтобы эти гены-мишени располагались в вирусном геноме на максимально возможном расстоянии (включая противоположные концы). Хотя в статье Кормана-Дростена описаны 3 праймера, эти праймеры покрывают лишь примерно половину генома вируса. Это еще один фактор, который снижает специфичность обнаружения интактной РНК вируса COVID-19 и увеличивает количество ложноположительных результатов тестов.
Следовательно, даже если мы получим три положительных сигнала (т.е. три пары праймеров дают 3 разных продукта амплификации) в образце, это не доказывает присутствие вируса. Лучшая конструкция праймера должна иметь концевые праймеры на обоих концах вирусного генома. Это связано с тем, что будет охвачен весь вирусный геном, и три положительных сигнала могут лучше различать полный (и, следовательно, потенциально заразный) вирусный геном от фрагментированного вирусного генома (без инфекционной активности). Чтобы сделать вывод об инфекционности вируса, нужно было включить ген Orf1, который кодирует основной фермент репликазы вирусов SARS-CoV (рис. 2). Позиционирование мишеней в той области вирусного генома, которая наиболее сильно и вариабельно транскрибируется, является еще одной слабостью протокола.
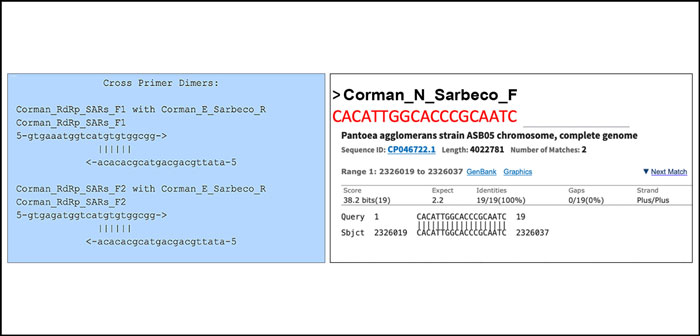
Kim et al. демонстрируют высоко вариабельную 3'-экспрессию субгеномной РНК в Sars-CoV-2 [23]. Эти РНК активно отслеживаются как сигнатуры для бессимптомных и неинфекционных пациентов [10]. Весьма сомнительно проводить скрининг популяции бессимптомных людей с помощью праймеров кПЦР, которые имеют праймер-димер из 6 пар оснований на 3 основных концах праймера (рис. 3). Видимо ВОЗ рекомендует эти праймеры. Мы протестировали все производные колебания протокола Кормана-Дростена с помощью инструмента для создания димерных материалов фирмы Thermofisher [11]. Прямой праймер RdRp имеет гомологию 3 п.н. с Sarbeco E Reverse. При высоких концентрациях праймера этого достаточно, чтобы создать неточности.
Примечание: один из праймеров N идеально соответствует клиническому патогену (Pantoea), обнаруженному у пациентов с ослабленным иммунитетом. Обратный праймер также поражает Pantoea, но не в той же области (рис. 3).
Это серьезные ошибки проектирования, поскольку тест не может различить вирус целиком и вирусные фрагменты. Тест нельзя использовать в качестве диагностики SARS-вирусов.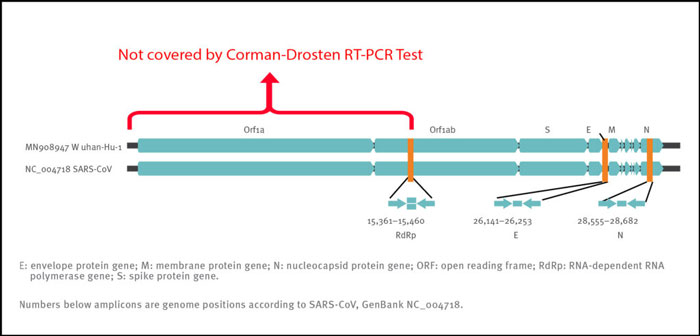
Рисунок 2: Относительное положение мишеней ампликонов на коронавирусе SARS и геноме нового коронавируса 2019 года. ORF: открытая рамка считывания; RdRp: РНК-зависимая РНК-полимераза. Цифры под ампликоном - это положения генома согласно SARS-CoV, NC_004718 [1];
2а) Температура плавления ДНК (> 92 °).
Адекватно рассмотрено в статье Кормана-Дростена.
2б) Температура амплификации ДНК.
Адекватно рассмотрено в статье Кормана-Дростена.
2c) Ошибочные данные GC и Tm
Температура отжига определяет, при какой температуре праймер прикрепляется/отсоединяется от целевой последовательности. Для эффективной и специфической амплификации содержание GC в праймерах должно соответствовать минимум 40% и максимуму 60% амплификации. Как показано в таблице 3, три праймера, описанные в статье Кормана-Дростена, не находятся в пределах нормального диапазона для содержания GC. Два праймера (RdRp_SARSr_F и RdRp_SARSr_R) имеют необычные и очень низкие GC-значения 28%-31% для всех возможных вариантов колебательных оснований, тогда как праймер E_Sarbeco_F имеет GC-значение 34,6% (Таблица 3 и вторая панель Таблицы 3) . Следует отметить, что содержание GC в значительной степени определяет связывание с его конкретной мишенью из-за трех водородных связей в спаривании оснований. Таким образом, чем ниже GC-содержание праймера, тем ниже его способность связываться с его конкретной последовательностью гена-мишени (т. Е. С геном, который должен быть обнаружен). Это означает, что для распознавания целевой последовательности мы должны выбрать температуру, которая как можно ближе к фактической температуре отжига (значение наилучшей практики), чтобы праймер не отслоился снова, и в то же время специально выбрать целевую последовательность.
Если значение Tm очень низкое, как это наблюдается для всех шатких вариантов обратных праймеров RdRp, праймеры могут неспецифично связываться с несколькими мишенями, снижая специфичность и увеличивая потенциальные ложноположительные результаты. Температура отжига (Tm) является решающим фактором для определения специфичности / точности процедуры qPCR и важна для оценки точности протоколов qPCR. Рекомендация по передовой практике: оба праймера (прямой и обратный) должны иметь почти одинаковое значение, предпочтительно одинаковое значение.
Мы использовали свободно доступное программное обеспечение для создания праймеров Primer-BLAST [12, 25], чтобы оценить лучшие практические значения для всех праймеров, использованных в статье Кормана-Дростена (таблица 3). Мы попытались найти значение Tm, равное 60 ° C, при этом аналогичным образом искали максимально возможное значение GC% для всех праймеров. Максимальное различие Tm 2 ° C внутри пар праймеров считалось приемлемым. Тестируя пары праймеров, указанные в статье Кормана-Дростена, мы наблюдали разницу в 10 ° C по отношению к температуре отжига Tm для пары праймеров 1 (RdRp_SARSr_F и RdRp_SARSr_R). Это очень серьезная ошибка, которая делает протокол бесполезным в качестве специального диагностического инструмента.
Дополнительное тестирование показало, что только пара праймеров, разработанная для амплификации N-гена (N_Sarbeco_F и N_Sarbeco_R), достигла адекватного стандарта для работы в диагностическом тесте, поскольку она имеет достаточное содержание GC и разницу Tm между праймерами (N_Sarbeco_F и N_Sarbeco_R). ) составляет 1,85 ° C (ниже критического максимума разницы в 2 ° C). Важно отметить, что это ген, который не тестировался в вирусных образцах (таблица 2) и не использовался в качестве подтверждающего теста. Помимо сильно изменяющихся температур плавления и вырожденных последовательностей в этих праймерах, существует еще один фактор, влияющий на специфичность процедуры: dNTP (0,4 мкМ) в 2 раза выше, чем рекомендуется для высокоспецифичной амплификации. В реакционную смесь также добавляют дополнительное количество сульфата магния. Эта процедура в сочетании с низкой температурой отжига может привести к неспецифическим усилениям. Если для количественной ПЦР требуется дополнительное количество магния, следует дополнительно изучить специфичность анализа.
Описанные здесь ошибки проектирования настолько серьезны, что маловероятно, что конкретная амплификация генетического материала SARS-CoV-2 будет происходить с использованием протокола статьи Кормана-Дростена.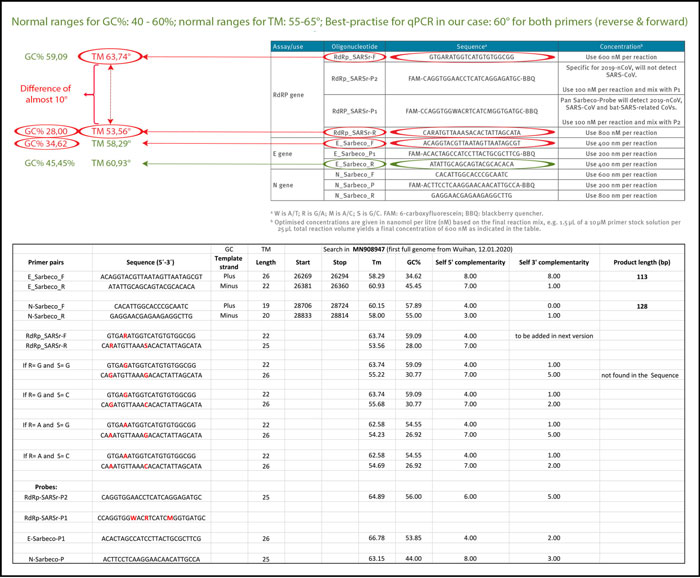
3. Количество циклов амплификации.
Следует отметить, что нигде в статье Кормана-Дростена нет упоминания о положительном или отрицательном результате теста или о том, что определяет положительный или отрицательный результат. Эти типы вирусологических диагностических тестов должны основываться на СОП, включая подтвержденное и фиксированное количество циклов ПЦР (значение Ct), после которых образец считается положительным или отрицательным. Максимально надежное значение Ct составляет 30 циклов. Выше Ct 35 циклов следует ожидать быстрого увеличения числа ложных срабатываний.
Данные ПЦР, оцененные как положительные после 35 циклов Ct, совершенно ненадежны.
Ссылаясь на Jaafar et al. 2020 [3]: «При Ct = 35 значение, которое мы использовали для сообщения о положительном результате ПЦР, <3% культур положительны». Другими словами, не было успешной изоляции вируса SARS-CoV-2 при таких высоких значениях Ct.
Кроме того, научные исследования показывают, что выявляются только неинфекционные (мертвые) вирусы со значением Ct 35 [22].
Между 30 и 35 есть серая зона, где нельзя с уверенностью установить положительный результат теста. Эту область следует исключить. Конечно, можно провести 45 циклов ПЦР, как рекомендовано в протоколе Кормана-Дростена ВОЗ (рис. 4), но тогда вам также необходимо определить разумное значение Ct (которое не должно превышать 30). Но аналитический результат со значением Ct 45 абсолютно бессмыслен с научной и диагностической точек зрения (разумное значение Ct не должно превышать 30). Обо всем этом нужно очень четко сообщить. Существенной ошибкой является то, что в статье Кормана-Дростена не упоминается максимальное значение Ct, при котором образец можно однозначно рассматривать как положительный или отрицательный результат теста. Этот важный пороговый предел цикла также не указан ни в каких последующих документах на сегодняшний день.

Рисунок 4: Рекомендация набора для ОТ-ПЦР в официальном протоколе ВОЗ Кормана-Дростена [8]. Можно найти только «циклическое» значение (циклы) без соответствующего и научно обоснованного Ct (порогового значения). Этого или любого другого значения циклов нигде нельзя найти в настоящей статье Кормана-Дростена.
Чтобы определить, действительно ли амплифицированные продукты являются генами SARS-CoV-2, необходима биомолекулярная проверка амплифицированных продуктов ПЦР. Для диагностического теста эта проверка абсолютно необходима.
Валидацию продуктов ПЦР следует выполнять либо путем прогона продукта ПЦР в 1% геле агарозы с EtBr вместе с индикатором размера (линейкой ДНК или лестницей ДНК), чтобы можно было оценить размер продукта. Размер должен соответствовать расчетному размеру продукта амплификации. Но еще лучше секвенировать продукт амплификации. Последнее даст 100% уверенность в идентичности продукта амплификации. Без молекулярной проверки нельзя быть уверенным в идентичности амплифицированных продуктов ПЦР. Учитывая серьезные конструктивные ошибки, описанные ранее, амплифицированные продукты ПЦР могут быть любыми.
Также в статье Кормана-Дростена не упоминается случай небольших фрагментов КПЦР (около 100 пар оснований): это может быть либо 1,5% гель агарозы, либо даже гель акриламида. Тот факт, что эти продукты ПЦР не прошли валидацию на молекулярном уровне, является еще одной поразительной ошибкой протокола, делающей любой тест, основанный на нем, бесполезным в качестве специального диагностического инструмента для идентификации вируса SARS-CoV-2.
5. Положительный и отрицательный контроли для подтверждения/опровержения обнаружения конкретного вируса.
Неподтвержденное предположение, описанное в статье Кормана-Дростена, заключается в том, что SARS-CoV-2 - единственный вирус из группы бета-коронавирусов, подобных SARS, который в настоящее время вызывает инфекции у людей. Последовательности, на которых основан их метод ПЦР, представляют собой последовательности in silico, предоставленные лабораторией в Китае [23], поскольку на момент разработки теста ПЦР не было контрольного материала инфекционного («живого») или инактивированного SARS-CoV- 2 и он не был доступен авторам. Поэтому тест ПЦР был разработан с использованием последовательности известного SARS-CoV в качестве контрольного материала для компонента Sarbeco (д-р Мейер, соавтор статьи Кормана-Дростена в электронном письме с доктором Питером Боргером) [2].
Предполагается, что все люди, получившие положительный результат с помощью теста RT-PCR, как описано в статье Кормана-Дростена, являются положительными на инфекции SARS-CoV-2. В их предположении есть три серьезных недостатка. Во-первых, положительный тест на молекулы РНК, описанный в статье Кормана-Дростена, не может быть приравнен к «заражению вирусом». Положительный тест ОТ-ПЦР просто указывает на присутствие молекул вирусной РНК. Как показано в пункте 1d (выше), тест Кормана-Дростена был разработан не для обнаружения полноразмерного вируса, а только для его фрагмента. Мы уже сделали вывод, что это классифицирует тест как непригодный в качестве диагностического теста на заражение вирусом SARS.
Во-вторых, что очень важно, функциональность опубликованного теста RT-PCR не была продемонстрирована с использованием положительного контроля (выделенная РНК SARS-CoV-2), который является важным научным золотым стандартом.
В-третьих, в статье Кормана-Дростена говорится:
«Чтобы показать, что эти анализы могут обнаруживать другие вирусы, связанные с SARS, связанные с летучими мышами, мы использовали анализ гена E для тестирования шести образцов фекалий, полученных от летучих мышей, доступных от Drexler et al. […] Und Muth et al. […]. Эти вирус-положительные образцы получены от европейских летучих мышей-ринолофидов. Обнаружение этих филогенетических отклонений в кладе CoV, связанной с SARS, предполагает, что все азиатские вирусы могут быть обнаружены. Теоретически это обеспечило бы широкую чувствительность даже в случае нескольких независимых приобретений вариантных вирусов из резервуара животных».
Это утверждение демонстрирует, что ген E, используемый в тесте RT-PCR, как описано в статье Кормана-Дростена, не специфичен для SARS-CoV-2.
Праймеры гена E также обнаруживают широкий спектр других вирусов SARS. Геном коронавируса является крупнейшим из всех РНК-вирусов, поражающих людей, и все они имеют очень похожую молекулярную структуру. Тем не менее, SARS-CoV1 и SARS-CoV-2 имеют два высокоспецифичных генетических отпечатка пальца, которые отличают их от других коронавирусов. Во-первых, уникальная последовательность отпечатков пальцев (KTFPPTEPKKDKKKK) присутствует в N-белке SARS-CoV и SARS-CoV-2 [13,14,15]. Во-вторых, и SARS-CoV1, и SARS-CoV2 не содержат белка HE, тогда как все другие коронавирусы обладают этим геном [13, 14]. Таким образом, для специфического обнаружения продукта ПЦР SARS-CoV1 и SARS-CoV-2 указанная выше область в гене N должна быть выбрана в качестве цели амплификации. Надежный диагностический тест должен фокусироваться на этой конкретной области гена N в качестве подтверждающего теста. ПЦР для этого гена N не была дополнительно подтверждена и рекомендована в качестве тестового гена в статье Дростена-Кормана из-за того, что она «не так чувствительна» к исходному зонду SARS-CoV [1].
Кроме того, отсутствие гена HE как в SARS-CoV1, так и в SARS-CoV-2 делает этот ген идеальным отрицательным контролем для исключения других коронавирусов. Протокол Кормана-Дростена не содержит ни этого отрицательного контроля, ни каких-либо других отрицательных контролей. Таким образом, тест ПЦР в статье Кормана-Дростена не содержит ни уникального положительного контроля, ни отрицательного контроля, чтобы исключить присутствие других коронавирусов. Это еще один серьезный недостаток конструкции, из-за которого тест классифицируется как непригодный для диагностики.
6. Стандартная операционная процедура (СОП) недоступна
Должна быть доступна стандартная операционная процедура (СОП), которая недвусмысленно определяет вышеуказанные параметры, чтобы все лаборатории могли установить одинаковые условия испытаний. Наличие утвержденной универсальной СОП очень важно, поскольку она облегчает сравнение данных внутри стран и между странами. Очень важно однозначно указать все параметры праймера. Отметим, что этого не было сделано. Кроме того, не указано значение Ct, указывающее, когда образец следует считать положительным или отрицательным. Также не указано, когда образец считается инфицированным вирусами SARS-CoV. Как показано выше, тест не может различить вирус и вирусные фрагменты, поэтому значение Ct, указывающее на положительность, имеет решающее значение. Это значение Ct должно быть указано в Стандартной операционной процедуре (СОП) и подключено к сети, чтобы все лаборатории, выполняющие этот тест, имели точно такие же граничные условия. Это указывает на ошибочность науки, что такой СОП не существует. Таким образом, лаборатории могут проводить испытания по своему усмотрению, что приводит к огромным вариациям. Лабораториям по всей Европе остается множество вопросов; какие грунтовки заказать? какие нуклеотиды заполнить неопределенными местами? какое значение Tm выбрать? Сколько циклов ПЦР нужно провести? При каком значении Ct образец положительный? А когда он отрицательный? А сколько генов тестировать? Следует ли тестировать все гены или только ген E и RpRd, как показано в таблице 2 статьи Кормана-Дростена? Следует ли тестировать и ген N? И каков их отрицательный контроль? Каков их положительный контроль?
Описанный протокол, к сожалению, очень расплывчат и ошибочен по своей конструкции, так что можно использовать десятки различных направлений. Кажется, что нет ни стандартизации, ни СОП, поэтому неясно, как этот тест может быть реализован.
7. Последствия ошибок, описанных в пунктах 1-5: ложноположительные результаты
Тест ОТ-ПЦР, описанный в статье Кормана-Дростена, содержит так много ошибок молекулярно-биологического дизайна (см. 1-5), что невозможно получить однозначные результаты. Неизбежно, что этот тест вызовет огромное количество так называемых «ложных срабатываний». Определение ложноположительных результатов - это отрицательный образец, который изначально дает положительный результат, но становится отрицательным после повторного тестирования с помощью того же теста. Ложноположительные результаты - это ошибочные положительные результаты теста, то есть отрицательные образцы, которые дают положительный результат. И это действительно то, что содержится в статье Кормана-Дростена. На странице 6 рукописи PDF авторы демонстрируют, что даже в хорошо контролируемых лабораторных условиях этот тест дает значительный процент ложных срабатываний:
«В четырех отдельных тестовых реакциях наблюдалась слабая начальная реактивность, однако они были отрицательными при повторном тестировании с помощью того же теста. Эти сигналы не были связаны с каким-либо конкретным вирусом, и для каждого вируса, с которым возникла исходная положительная реактивность, были другие образцы, которые содержали тот же вирус в более высокой концентрации, но не дали положительного результата теста. Учитывая результаты обширной технической аттестации, описанной выше, был сделан вывод, что эта начальная реактивность не была связана с химической нестабильностью ПЦР-зондов в реальном времени и, скорее всего, с проблемами, вызванными быстрым внедрением новых диагностических тестов и средств контроля во время этой оценки. исследование." [1]
Первое предложение этого отрывка является четким доказательством того, что тест ПЦР, описанный в статье Кормана-Дростена, дает ложноположительные результаты. Даже в хорошо контролируемых условиях современной лаборатории Шарите 4 из 310 первичных тестов по определению являются ложноположительными. Четыре отрицательных образца первоначально дали положительный результат, а затем оказались отрицательными при повторном тестировании. Это классический пример ложного срабатывания. В этом случае авторы не идентифицируют их как ложные срабатывания, что является интеллектуально нечестным. Еще одно показательное наблюдение в приведенном выше отрывке состоит в том, что авторы объясняют ложные срабатывания «устранением проблем, вызванных быстрым внедрением новых диагностических тестов». Представьте себе лаборатории, которые должны внедрить тест без всей необходимой информации, обычно описываемой в СОП.
8. Документ Кормана-Дростен не рецензировался
Перед официальной публикацией в научном журнале научные и медицинские статьи традиционно заверяются «экспертной оценкой». В этом процессе редакторы журнала следуют советам различных экспертов («рецензентов»), которые оценивали статью и могут выявить слабые места в ее предположениях, методах и выводах. Обычно журнал публикует статью только после того, как редакторы будут удовлетворены тем, что авторы учли вопросы рецензентов и что представленные данные подтверждают выводы, сделанные в статье ». Этот процесс также описан в Евронаблюдении [16].
Документ Кормана-Дростен был передан в Еврононадзор 21 января 2020 года и принят к публикации 22 января 2020 года. 23 января 2020 года статья была размещена в сети. 13 января 2020 года версия 1-0 протокола была опубликована на официальном веб-сайте ВОЗ [17], обновленная 17 января 2020 года как версия документа 2-1 [18], даже до того, как статья Кормана-Дростена была опубликована 23 января в Евронаблюдение.
Обычно экспертная оценка - это трудоемкий процесс, поскольку по крайней мере два эксперта в данной области должны критически прочитать и прокомментировать представленный документ. На наш взгляд, статья не рецензировалась. Двадцати четырех часов просто недостаточно для проведения тщательной экспертной оценки. Наш вывод подтверждается тем фактом, что нами было обнаружено огромное количество очень серьезных недостатков конструкции, которые делают тест ПЦР совершенно непригодным в качестве диагностического инструмента для идентификации вируса SARS-CoV-2.
Любой молекулярный биолог, знакомый с дизайном ОТ-ПЦР, легко заметил бы серьезные ошибки, содержащиеся в статье Кормана-Дростена, до фактического процесса обзора. 26 октября 2020 года мы попросили Евронаблюдение прислать нам копию отчета экспертной оценки. На сегодняшний день мы не получили этот отчет и в письме от 18 ноября 2020 г. ECDC как принимающая сторона Евронаблюдения отказался предоставить доступ, не предоставив существенных научных оснований для своего решения. Напротив, они пишут, что «раскрытие информации подорвет цель научных исследований». [24].
9. Авторы как редакторы
Последний пункт вызывает серьезную озабоченность. Оказывается, два автора статьи Кормана-Дростена, Кристиан Дростен и Шанталь Реускен, также являются членами редколлегии этого журнала [19]. Следовательно, существует серьезный конфликт интересов, который усиливает подозрения, что статья не рецензировалась. Создается впечатление, что быстрая публикация стала возможной просто потому, что авторы также входили в редакционную коллегию Eurosurveillance. Эта практика классифицируется как компрометация научной честности.
КРАТКИЙ КАТАЛОГ ОШИБОК, НАЙДЕННЫХ В РУКОПИСИ
Статья Кормана-Дростена содержит следующие конкретные ошибки:
1. В этом протоколе нет конкретной причины использовать эти чрезвычайно высокие концентрации праймеров. Описанные концентрации приводят к увеличению неспецифических связываний и амплификации продуктов ПЦР, что делает тест непригодным в качестве специального диагностического инструмента для идентификации вируса SARS-CoV-2.
2. Шесть неопределенных шатких положений внесут огромное разнообразие в реальную лабораторную реализацию этого теста; сбивающее с толку неспецифическое описание в статье Кормана-Дростена не подходит в качестве стандартного рабочего протокола, что делает этот тест непригодным в качестве специального диагностического инструмента для идентификации вируса SARS-CoV-2.
3. Тест не может отличить вирус целиком от вирусных фрагментов. Таким образом, тест не может использоваться в качестве диагностики интактных (инфекционных) вирусов, что делает тест непригодным в качестве специального диагностического инструмента для выявления вируса SARS-CoV-2 и заключения о наличии инфекции.
4. Разница в 10 ° C в отношении температуры отжига Tm для пары праймеров 1 (RdRp_SARSr_F и RdRp_SARSr_R) также делает тест непригодным в качестве специального диагностического инструмента для идентификации вируса SARS-CoV-2.
5. Серьезная ошибка - это пропуск значения Ct, при котором образец считается положительным и отрицательным. Это значение Ct также не обнаружено в последующих материалах, что делает тест непригодным в качестве специального диагностического инструмента для выявления вируса SARS-CoV-2.
6. Продукты ПЦР не прошли валидацию на молекулярном уровне. Этот факт делает протокол бесполезным в качестве специального диагностического инструмента для выявления вируса SARS-CoV-2.
7. Тест ПЦР не содержит ни уникального положительного контроля для оценки его специфичности в отношении SARS-CoV-2, ни отрицательного контроля для исключения наличия других коронавирусов, что делает тест непригодным в качестве специального диагностического инструмента для выявления SARS-CoV-2. вирус.
8. Схема теста в статье Кормана-Дростена настолько расплывчата и ошибочна, что можно пойти в десятках разных направлений; нет ничего стандартизированного и нет СОП. Это ставит под сомнение научную обоснованность теста и делает его непригодным в качестве специального диагностического инструмента для выявления вируса SARS-CoV-2.
9. Скорее всего, статья Кормана-Дростен не прошла рецензирование, что сделало тест непригодным в качестве специального диагностического инструмента для идентификации вируса SARS-CoV-2.
10. Мы находим серьезные конфликты интересов по крайней мере у четырех авторов, в дополнение к тому факту, что два из авторов статьи Кормана-Дростена (Кристиан Дростен и Шанталь Реускен) являются членами редакционной коллегии Eurosurveillance. 29 июля 2020 года был добавлен конфликт интересов (Ольферт Ландт - генеральный директор TIB-Molbiol; Марко Кайзер - старший научный сотрудник GenExpress и научный консультант TIB-Molbiol), что не было заявлено в первоначальной версии (и до сих пор остается отсутствует в версии PubMed); TIB-Molbiol - компания, которая была «первой», кто произвел наборы для ПЦР (Light Mix) на основе протокола, опубликованного в рукописи Кормана-Дростена, и, по их собственным словам, они распространяли эти наборы для ПЦР-тестов до того, как публикация была опубликована. даже представил [20]; далее, Виктор Корман и Кристиан Дростен не упомянул их вторую принадлежность: коммерческую испытательную лабораторию Labor Berlin. Оба отвечают за диагностику вирусов [21], а компания занимается ПЦР-тестированием в реальном времени.
В свете нашего повторного изучения протокола тестирования для выявления SARS-CoV-2, описанного в документе Кормана-Дростена, мы выявили ошибки и внутренние ошибки, которые делают бесполезным тест SARS-CoV-2 PCR.
ВЫВОД
Решение о том, какие протоколы испытаний опубликовать и сделать широко доступными, находится непосредственно в руках Евронаблюдения. Решение признать ошибки, очевидные в статье Кормана-Дростена, позволяет значительно минимизировать человеческие затраты и страдания в будущем.
Разве не в интересах Евронаблюдения отозвать этот документ? Наш вывод ясен. Перед лицом всех огромных недостатков и ошибок конструкции протокола ПЦР, описанных здесь, мы делаем вывод: остается не так много выбора в рамках научной честности и ответственности.
ССЫЛКИ
[1] Корман Виктор М., Ландт Ольферт, Кайзер Марко, Моленкамп Рихард, Мейер Адам, Чу Даниэль К.В., Блейкер Тобиас, Брюнинк Себастьян, Шнайдер Джулия, Шмидт Мари Луиза, Малдерс Дафна Дж. Дж. К., Хаагманс Барт Л., ван дер Вир Бас, ван ден Бринк Шарон, Вейсман Лиза, Годерски Габриэль, Рометт Жан-Луи, Эллис Джоанна, Замбон Мария, Пейрис Малик, Гуссенс Херман, Реускен Шанталь, Купманс Марион П.Г., Дростен Кристиан. Обнаружение нового коронавируса 2019 года (2019-nCoV) с помощью ОТ-ПЦР в реальном времени. Euro Surveill. 2020; 25 (3): pii = 2000045.
[2] Электронная переписка между доктором Питером Боргером и доктором Адамом Мейджером.
[3] Джафаар и др., Корреляция между 3790 образцами с положительными результатами количественной полимеразной цепной реакции и положительными культурами клеток, включая 1941 изолятов коронавируса 2 с тяжелым острым респираторным синдромом.
4] BBC, 21 января 2020 г .; Архив.
[5] Google Analytics - COVID19-смертей во всем мире; Архив.
[6] Лабораторные испытания Технического центра экстренного реагирования на COVID-19, NIVD при Центре контроля заболеваний Китая, 15 марта 2020 г.
[7] Справочник по технологиям ПЦР в реальном времени.
Нолан Т., Хаггетт Дж., Санчес Э. Хорошее практическое руководство по применению количественной ПЦР (qPCR) Первое издание 2013 г.
[8] Трестан Пиллонел и др., Письмо редактору: обнаружение SARS-CoV-2 с помощью ОТ-ПЦР в реальном времени:
[9] Куркела, Сату, и Дэвид В.Г. Браун. «Молекулярно-диагностические методы». Медицина 38.10 (2009): 535-540.
[10] Вольфель и др., Вирусологическая оценка госпитализированных пациентов с COVID-2019
[11] Веб-инструмент Thermofischer Primer Dimer.
12] Primer-BLAST, NCBI - Национальный центр биотехнологической информации.
[13] Марра М.А., Стивен Дж.М.Дж., Кэролайн Р.А., Роберт А.Х., Анджела Б.В. и др. (2003) Наука. Последовательность генома коронавируса, ассоциированного с SARS. Наука 300 (5624): 1399-1404.
[14] Изолят коронавируса 2 тяжелого острого респираторного синдрома Ухань-Ху-1, полный геном.
[15] Боргер П. Ожидался коронавирус, похожий на атипичную пневмонию, но ничего не было сделано для подготовки. Am J Biomed Sci Res 2020.
[16] Процесс оценки/проверки документов Евронадзора.
[17] Официальная рекомендация протокола Кормана-Дростена и рукопись ВОЗ, опубликованные 13 января 2020 года как версия документа 1.0: Архив.
[18] Официальная рекомендация ВОЗ по протоколу RT-qPCR Кормана / Дростена, которая непосредственно вытекает из публикации Eurosurveillance, версия документа 2-1, опубликованной 17 января 2020 г.
[19] Редакционный совет Eurosurveillance, 2020:
[20] Инструкции по применению LightMix SarbecoV E-gene plus EAV Control, TIB-Molbiol & Roche Molecular Solutions, 11 января 2020 г.:
Архив, отметка времени - 11 января 2020 г.
[21] Кристиан Дростен и Виктор Корман, ответственные за вирусную диагностику в Labor Berlin:
[22] Том Джефферсон, Элизабет Спенсер, Джон Брасси, Карл Хенеган. Вирусные культуры для оценки инфекционности COVID- 19. Регулярный обзор. Систематический обзор doi:
[23] Ким и др., Архитектура транскриптома SARS-CoV-2.
[24] Ответ ECDC д-ру Питеру Боргеру, 18 ноября 2020 г.
[25] Проф. Д-р Ульрике Каммерер и команда, исследование и таблица Primer-BLAST.
Дополнительная литература:
Описание RT-PCR RKI Germany, на странице 10 этой ссылки.
Принадлежность авторов:
1) Д-р Питер Боргер (магистр, доктор философии), молекулярная генетика, научный сотрудник W + W, Лёррах, Германия
2) Раджеш Кумар Малхотра (художник, псевдоним: Бобби Раджеш Малхотра ), бывший 3D-художник / научные визуализации в CeMM - Центре молекулярной медицины Австрийской академии наук (2019-2020), Университет прикладных искусств - Департамент цифровых искусств Вены, Австрия
3) Д-р Майкл Йидон, BS (с отличием) Biochem Tox U Surrey, PhD Pharmacology U Surrey. Управляющий директор Yeadon Consulting Ltd, бывший главный научный сотрудник Pfizer, Великобритания
4) Д-р Клэр Крейг, Массачусетс, (Кантаб), BM, BCh (Oxon), FRCPath, Соединенное Королевство
5) Кевин МакКернан , BS Emory University, главный научный сотрудник, основатель Medical Genomics, спроектировал конвейер секвенирования в WIBR / MIT для проекта «Геном человека», изобрел и разработал секвенатор SOLiD, получил патенты, связанные с ПЦР, выделением и секвенированием ДНК, США
6) Профессор доктор Клаус Штегер , отделение урологии, детской урологии и андрологии, молекулярной андрологии, Центр биомедицинских исследований Университета Юстуса Либиха, Гиссен, Германия
7) Д-р Пол МакШихи (бакалавр, доктор философии), биохимик и промышленный фармаколог, Леррах, Германия
8) Доктор Лидия Ангелова , магистр биологии, кандидат микробиологии, бывший научный сотрудник Национального института аллергии и инфекционных заболеваний (NIAID), Мэриленд, США.
9) Д-р Фабио Франки , бывший врач Dirigente Medico (MD) в отделении инфекционных заболеваний, специализирующийся на «инфекционных заболеваниях» и «гигиене и профилактической медицине», Società Scientifica per il Principio di Precauzione (SSPP), Италия.
10) Доктор мед. Томас Биндер, терапевт и кардиолог (FMH), Швейцария
11) Проф. Д-р мед. Хенрик Ульрих, специалист по диагностической радиологии, главный врач Центра радиологии больницы Кольм-Ошац, Германия
12) Профессор доктор Макото Охаси , почетный профессор, доктор микробиологии и иммунологии, Университет Токусима, Япония
13) Д-р Стефано Скольо, бакалавр наук Ph.D., микробиолог, диетолог, Италия
14) Д-р Марджолейн Дусбург-ван Клеффенс (магистр, доктор философии), специалист в области лабораторной медицины (клиническая химия), Maasziekenhuis Pantein, Beugen, Нидерланды
15) Доктор Доротея Гилберт (магистр, доктор философии), доктор химических наук и токсикологии окружающей среды. DGI Consulting Services, Осло, Норвегия
16) Д-р Райнер Дж. Клемент, доктор философии. Отделение радиационной онкологии, больница Леопольдина, Швайнфурт, Германия
17) Доктор Рут Шруфер, доктор философии, генетика / иммунология человека, Мюнхен, Германия,
18) Dra. Бербер В. Пиксма, врач общей практики, Нидерланды
19) Доктор мед. Ян Бонт (GJ), консультант-невролог, Нидерланды
20) Д-р Бруно Х. Далле Карбонар (молекулярный биолог), специалист по интеллектуальной собственности, BDC Basel, Швейцария
21) Д-р Кевин П. Корбетт , магистр медсестер (Королевский колледж Лондона), доктор философии (Южный берег Лондона), социальные науки (исследования в области науки и технологий) Лондон, Англия, Соединенное Королевство
22) Проф. Д-р Ульрике Каммерер, специалист в области вирусологии / иммунологии / биологии человека / клеточной биологии, Университетская клиника Вюрцбурга, Германия
Оригинал статьи Review report Corman-Drosten et al. Eurosurveillance 2020



